Sådan udføres serielle fortyndinger
Forfatter:
Roger Morrison
Oprettelsesdato:
19 September 2021
Opdateringsdato:
11 Kan 2024
Indhold
- etaper
- Metode 1 Udfør en simpel fortynding
- Metode 2 Beregn den endelige fortyndingsfaktor og koncentration
I kemi består en fortynding af at reducere koncentrationen af en given opløsning. En seriefortynding er simpelthen en gentagen fortynding af en original opløsning for hurtigt at amplificere fortyndingsfaktoren. Denne type fortynding udføres ofte under eksperimenter, der kræver stærkt fortyndede opløsninger og høj nøjagtighed, såsom dem, der involverer koncentrationskurver i en logskala eller dem, der tillader beregning af tætheden af bakterier i visse medier. De udføres meget ofte inden for biokemi, mikrobiologi, farmakologi eller kemi.
etaper
Metode 1 Udfør en simpel fortynding
-

Bestem den rigtige fortyndingsvæske (eller fortyndingsmiddel). Valget af fortyndingsmiddel er meget vigtigt og afhænger af den løsning, du vil fortynde. Fortyndingsmidlet er ofte destilleret vand, men det er ikke systematisk. Med en opløsning, der indeholder bakterier eller celler, anvendes der således et kulturmedium i stedet. Til seriefortynding bruges det samme fortyndingsmiddel i alle rør.- Hvis du ikke er sikker på, hvilket fortyndingsmiddel du skal bruge, skal du få hjælp fra en kompetent person eller kigge på Internettet efter, hvad folk skal gøre for en lignende oplevelse.
-
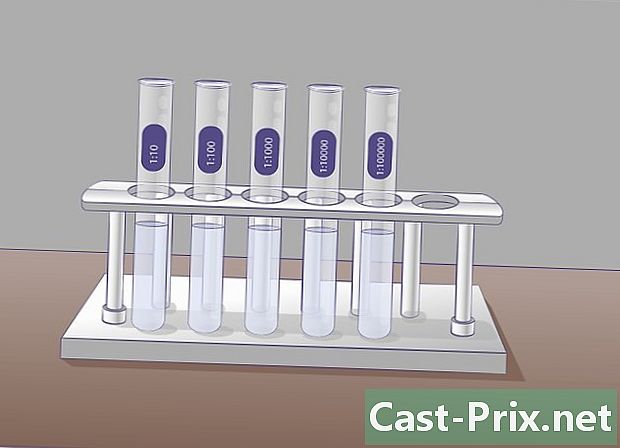
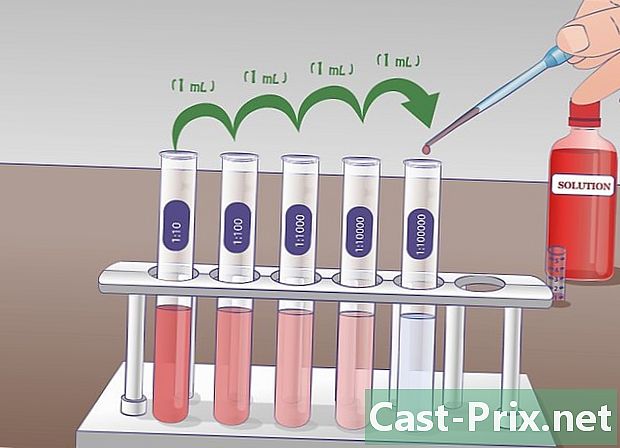
Forbered flere prøverør indeholdende 9 ml fortyndingsvæske. Disse reagensglas vil blive brugt til at fremstille successive fortyndinger. Princippet er enkelt, du vil tage en prøve af startopløsningen og overføre den til det næste rør, derefter tage en prøve af dette rør for at sætte det i det næste osv.- Inden start af fortyndingerne, tilrådes det på forhånd at identificere prøverørene for at undgå forvirring senere.
- I hvert rør har du en koncentration, der er ti lavere end i det foregående. Det første rør vil indeholde en fortyndet opløsning i den tiende, anden, hundrededel, tredje, tusindedel osv. Bestem på forhånd antallet af fortyndinger for at undgå at fremstille flere rør end nødvendigt og affaldsfortyndingsmiddel unødigt.
-
Forbered et reagensglas med din moropløsning. Put mindst 2 ml. Den mindste mængde stamopløsning til seriefortynding er en milliliter. Tillad 2 ml til en mulig anden fortynding. Dette rør med moropløsning, du kan markere det som en "SM".- Før start med en seriefortynding, bland startblandingen godt.
-
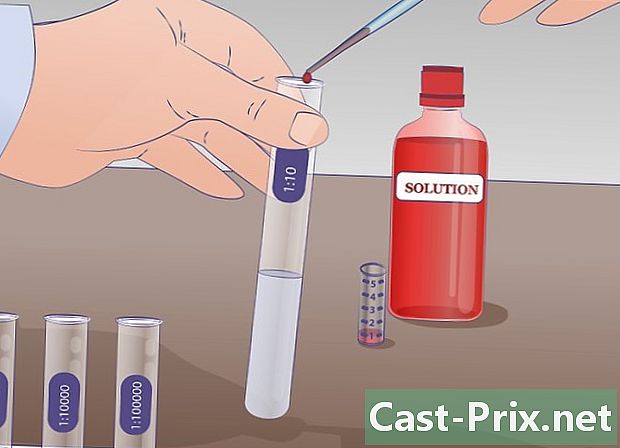
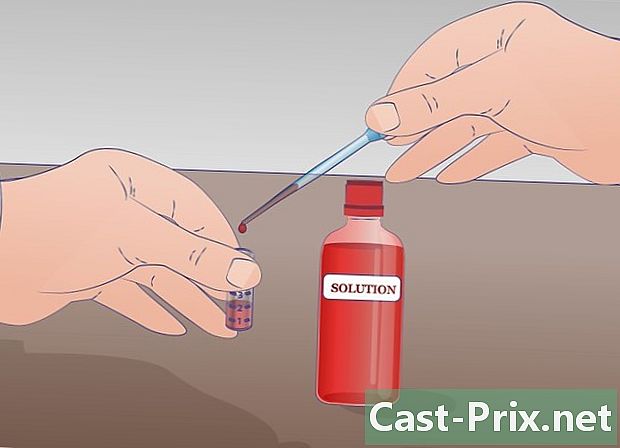
Lav den første fortynding. Pipetter 1 ml af stamopløsningen i prøverøret mærket "SM" og overfør denne mængde til det mærkede reagensglas. 1/10 som allerede indeholder 9 ml fortyndingsvæske. Bland for at få en homogen opløsning. I dette rør er der nu 10 ml opløsning: 1 ml stamopløsning og 9 ml fortyndingsvæske. Denne nye løsning er ti gange mindre koncentreret end den foregående. -
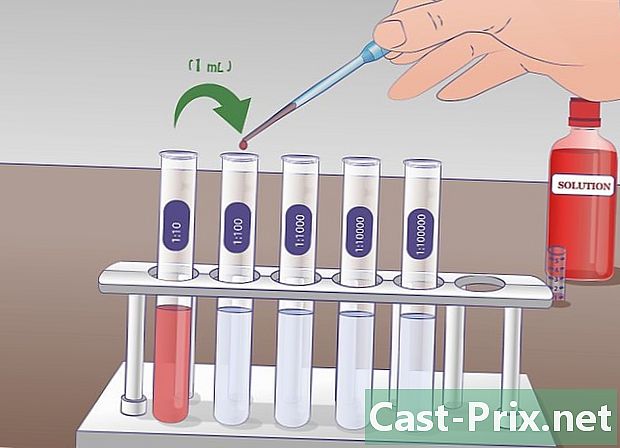
Udfør den anden fortynding. I den anden seriefortynding trækker du 1 ml af den mærkede røropløsning 1/10 og du hælder det i røret 1/100 som allerede indeholder 9 ml fortyndingsvæske. Røret 1/10 vil have været godt blandet før prøveudtagning. Når overførslen er udført, blandes røret godt 1/100. Opløsningen fra det markerede rør 1/10 er 10 gange mere koncentreret end det mærkede rør 1/100. -

Gentag denne manipulation om nødvendigt. Denne procedure kan gentages så mange gange som ønsket, indtil den ønskede fortynding er opnået. For et eksperiment, der involverer koncentrationskurver, kan du således få en række opløsninger med fortyndinger til enheden, den tiende (1/10), den hundrededelste (1/100) eller den tusindedelste (1/1000).
Metode 2 Beregn den endelige fortyndingsfaktor og koncentration
-

Beregn forholdet den endelige fortynding efter seriefortynding. Det samlede fortyndingsforhold opnås ved at multiplicere fortyndingsfaktoren i sig selv så mange gange som der er fortyndinger. Matematisk set er formlen som følger: Dt = D1 x D2 x D3 x ... x Dnmed Dt repræsenterer den samlede fortyndingsfaktor og Dn, forholdet mellem fortynding.- Så lad os antage, at du udfører en 1/10 fortynding af en væske 4 gange i træk. I formlen skal du erstatte fortyndingsfaktoren med dens værdi: Dt = 10 x 10 x 10 x 10 = 10.000
- Den sidste fortyndingsfaktor for det fjerde rør i din seriefortynding er 1/10 000. Koncentrationen af opløsningen af det sidste rør er nu 10 000 gange lavere end den oprindelige opløsnings.
-

Bestemm koncentrationen af en opløsning efter fortynding. For at finde den endelige koncentration af en opløsning efter seriefortynding skal du vide startkoncentrationen. Formlen er derefter: Cendelige = Cindledende/ Amed Cendelige der repræsenterer den terminale koncentration af den fortyndede opløsning, Cindledende, koncentrationen af stamopløsningen og D, forholdet mellem den fortyndede bestemmelse.- Så hvis du fortynder en celleopløsning med en koncentration på 1.000.000 celler pr. Ml og dit fortyndingsforhold blev sat til 1.000, hvad vil den endelige koncentration af din fortyndede prøve være?
- Brug formlen:
- Cendelige = Cindledende/ A
- Cendelige = 1 000 000/1 000
- Cendelige = 1000 celler / ml
-

Vær opmærksom på de anvendte enheder. Når du foretager dine beregninger, skal du altid kontrollere, at du bruger de samme enheder. Så hvis du starter med en koncentration af celler pr. Ml, vil dit endelige resultat også være i celler pr. Ml. Hvis din startkoncentration er i dele pr. Million (ppm), vil din slutkoncentration være i dele pr. Million.