Hvordan man navngiver kemiske forbindelser
Forfatter:
Laura McKinney
Oprettelsesdato:
2 April 2021
Opdateringsdato:
26 Juni 2024
Indhold
- etaper
- Metode 1 Nomenklatur af ioniske forbindelser
- Metode 2 Nomenklatur af polyatomiske forbindelser
- Metode 3 Nomenklatur af kovalente forbindelser
For at få succes inden for kemi kræver det, at man ved, hvordan man navngiver de basiske kemiske forbindelser. Denne vejledning giver dig grundlæggende regler for navngivningsprocessen for kemiske forbindelser, og hvordan du tildeler navne til forbindelser, der ikke er ukendt for dig.
etaper
Metode 1 Nomenklatur af ioniske forbindelser
- Hvad er en ionforbindelse? Ioniske forbindelser består af et metal og et ikke-metal. Henvis derefter til den periodiske tabel med elementer for at vide, hvilke kategorier der hører til elementerne, der findes i forbindelsen.
-

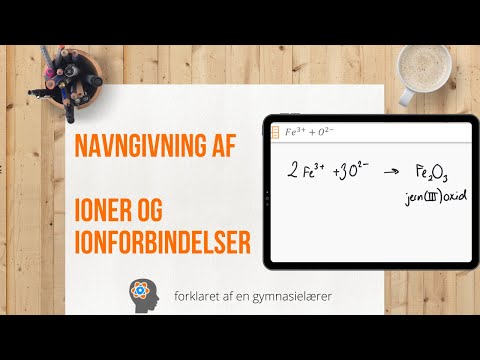
Form navnet. Intet er lettere end at navngive en ionisk forbindelse med to elementer. Faktisk svarer den første del af navnet på forbindelsen til navnet på det ikke-metalliske element, der bærer suffikset "ure", mens den anden svarer til navnet på metalelementet. Der er undtagelser: oxid, fosfid, nitrid, sulfid.- Eksempel: Al2O3. al2 = Aluminium; O3 = Oxygen. Så navnet på forbindelsen vil være "aluminiumoxid".
-
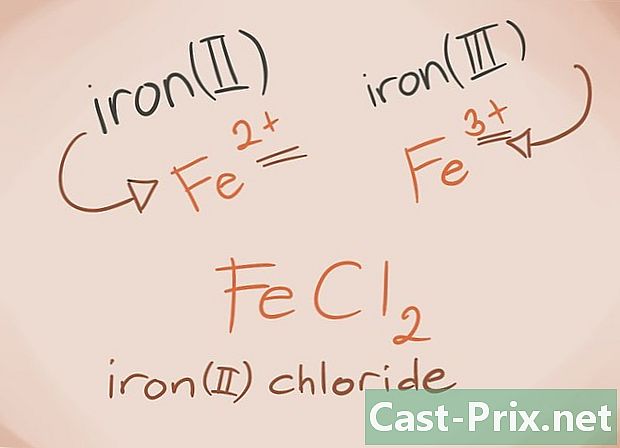
Kend overgangsmetaller. Overgangsmetaller er dem, der findes i D- og F-blokke i den periodiske tabel. I forbindelsens navn er afgiften på disse metaller skrevet med romerske tal. Dette skyldes, at overgangsmetaller kan bære mere belastning og danne mere af en forbindelse.- Eksempel: FeCl2 og FeCl3. Fe = jern; cl2 = -2 chlorid; cl3 = Chlor -3. Som navne vil der være jernchlorid (II) og jernchlorid (III).
Metode 2 Nomenklatur af polyatomiske forbindelser
-

Du er nødt til at forstå, hvad en polyatomisk forbindelse er. Polyatomiske forbindelser er forbindelser, der dannes af en gruppe datomer, der er forbundet med hinanden; hele gruppen med et gebyr er positivt eller negativt. Der er derefter tre grundlæggende handlinger, som du kan udføre på polyatomiske forbindelser:- Du kan tilføje et brint til den første del af forbindelsen. Ordet "brint" tilføjes faktisk i begyndelsen af navnet på forbindelsen. Dette reducerer værdien af den negative ladning med en. F.eks. "Carbonat" CO3 bliver "hydrogencarbonat" HCO3.

- Du kan også fjerne ilt fra forbindelsen. Belastningen ændres ikke, men forbindelsen "-ate" af forbindelsen ændres til "-ik". For eksempel transformationen af: NO3 i NO2 vi går fra nitrat til nitrat. "

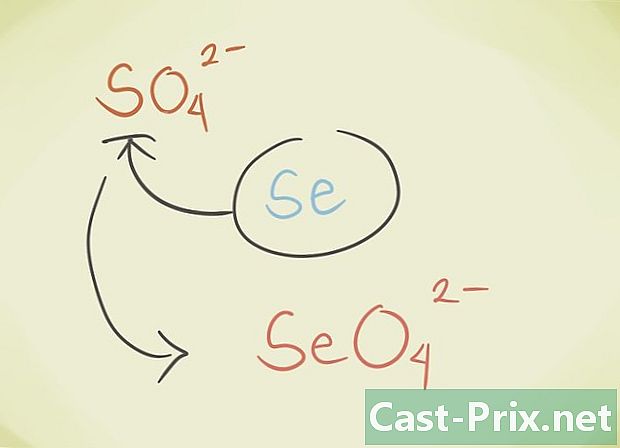
- Du kan erstatte forbindelsens centrale latome med et andet atom, der tilhører den samme periodiske gruppe. F.eks. SO-sulfat4 kan erstattes af Selenate SeO4.
- Du kan tilføje et brint til den første del af forbindelsen. Ordet "brint" tilføjes faktisk i begyndelsen af navnet på forbindelsen. Dette reducerer værdien af den negative ladning med en. F.eks. "Carbonat" CO3 bliver "hydrogencarbonat" HCO3.
-

Husk de mest almindelige diongrupper. Grupperne nedenfor bruges til at danne de fleste polyatomiske forbindelser. Efter den stigende rækkefølge af deres negative debitering har vi:- hydroxidioner: OH
- nitrationer: NO3
- Hydrogencarbonationer: HCO3
- permanganationer: MnO4
- carbonationer: CO3
- kromater: CrO4
- dichromate-ioner: Cr2O7
- sulfationer: SO4
- sulfitioner: SO3
- thiosulfationer: S2O3
- Fosfationer: PO4
- ammoniumioner: NH4
- Opret sammensatte navne fra listen ovenfor. Dann en navneforening med et af de elementer, der er relateret til gruppen. Hvis elementet er placeret foran den ioniske gruppe, tilføjes elementets navn simpelthen til starten af det sammensatte navn.
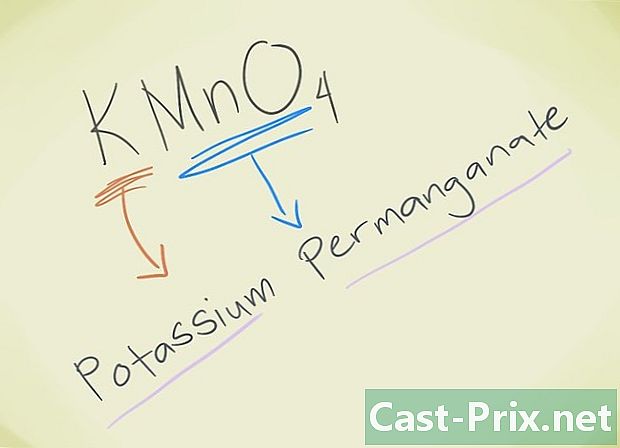
- Eksempel: KMnO4. Du skal være i stand til at kende den løve MnO4 svarer til løvepermanganat. K henviser til kalium. Så din forbindelse kaldes Permanganat Kalium.
- Eksempel: NaOH. Du vil sandsynligvis have forstået her, at det er OHOH. Na er natrium, så forbindelsen kaldes natriumhydroxid.

- Eksempel: KMnO4. Du skal være i stand til at kende den løve MnO4 svarer til løvepermanganat. K henviser til kalium. Så din forbindelse kaldes Permanganat Kalium.
Metode 3 Nomenklatur af kovalente forbindelser
-
Hvad er en kovalent forbindelse? De kovalente forbindelser er resultatet af forbindelsen af mindst to ikke-metalliske elementer. Navnet på forbindelsen bestemmes af antallet af datomer, der udgør det. Det græske præfiks ved siden af dette navn angiver antallet af molekyler, der er til stede i forbindelsen. -
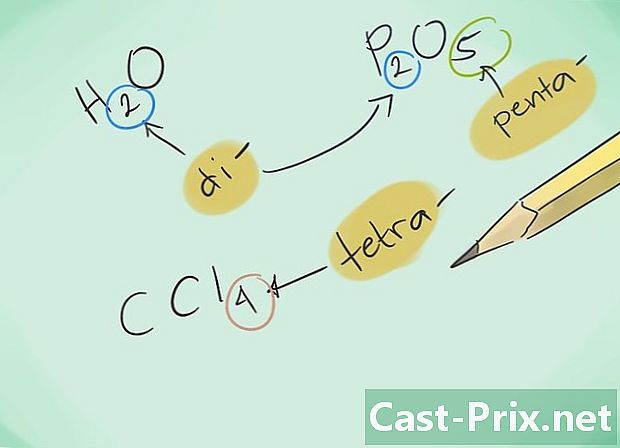
Gør dig bekendt med præfikserne. Husk følgende præfikser for forbindelser med 1 til 8 atomer:- 1 atom - "Mono-"
- 2 atomer - "Di-"
- 3 atomer - "Tri-"
- 4 atomer - "Tetra-"
- 5 atomer - "Penta-"
- 6 atomer - "Hexa-"
- 7 atomer - "Hepta-"
- 8 atomer - "Octa-"
- Navn derefter forbindelserne. Navngiv den resulterende forbindelse ved hjælp af de relevante præfikser. Præfikterne podes på hvert af elementerne, der udgør en forbindelse med flere atomer.
- Eksempel: CO vender tilbage til kulilte, mens CO2 angiver kuldioxid.
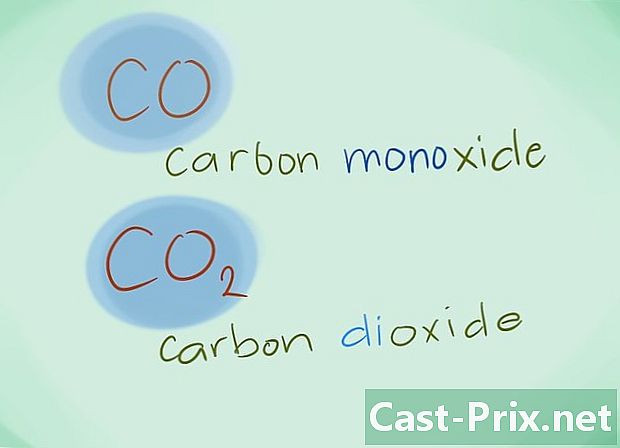
- Eksempel: N2S3 ville svare til nitrøst trisulfid.

- I de fleste tilfælde kan præfikset "mono" udelades; dette inducerer mere end nogen mangel på præfikser, at sidstnævnte skal anvendes. Dette præfiks bruges fortsat i tilfælde af kulilte, idet denne anvendelse går tilbage til de første glimmer inden for kemi.
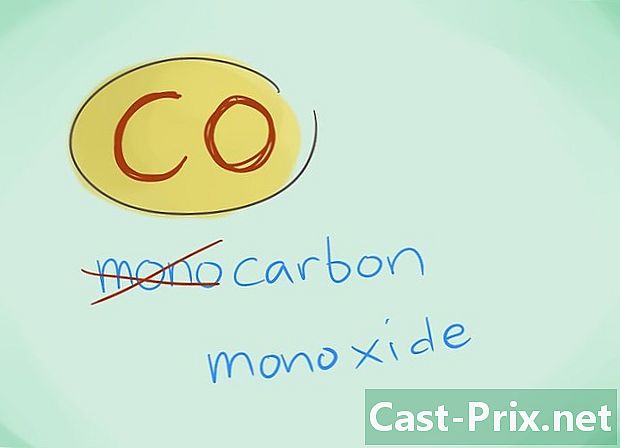
- Eksempel: CO vender tilbage til kulilte, mens CO2 angiver kuldioxid.
- Selvfølgelig har du mistanke om, at flere undtagelser gælder for alle disse regler; hold for eksempel denne formel, CaCl2Du forventer at se det kaldes "calciumdichlorid", hvilket er NEJ. Din forbindelse beholder simpelthen navnet calciumchlorid.
- Det skal også bemærkes, at alt dette ikke gælder for organisk kemi.
- De detaljerede regler her er beregnet til et begyndert publikum inden for kemi og videnskab. Der er meget forskellige regler, når du gennemgår det avancerede kemistadium, som reglerne for variabel valens.

